S.O.S. Suínos
Informativo Técnico nº 64
SUINOCULTURA
Utilização de Fitases na Suinocultura
AUTOR: Tiago Tedeschi dos Santos, Médico
Veterinário (UFPr); Mestre em Zootecnia, Área de Concentração: Qualidade e
produtividade animal (FZEA/USP)Gerente Técnico AB Vista Feed Ingredients,
Brasil
A utilização de enzimas exógenas na nutrição de monogástricos tem como
principal objetivo manipular as condições existentes no trato digestivo e
melhorar o valor nutricional dos ingredientes (Meng et al., 2005), sendo que seu
uso tem se tornado cada vez mais comum durante as últimas duas décadas
(Selle e Ravindran, 2007).
No Brasil, o uso de enzimas na nutrição de monogástricos tem também
crescido, tendo como base fundamental a redução do custo de formulação obtida
quando da inclusão destes produtos na formulação, adicionalmente ainda, fatores
como melhoria do desempenho animal e redução da capacidade poluente dos dejetos
animais também têm sido pontos levantados como importantes na adoção desta
tecnologia. Com o aumento do custo de matérias-primas observado a partir da
metade de 2007, somando-se até mesmo a escassez temporária de algumas destas
que foram destinadas para outros fins (produção de fertilizantes e
biocombustíveis), a utilização de enzimas na nutrição animal no Brasil teve seu
uso intensificado.
Comercialmente, as enzimas presentes no mercado nacional são divididas em
dois grandes grupos, as fitases (que atuam aumentando a liberação do fósforo
contido nos ingredientes vegetais, diminuindo assim a adição de fontes
inorgânicas, além de um enfoque sobre aumento de digestibilidade de aminoácidos
e metabolizabilidade de energia) e as enzimas comumente chamadas de enzimas
para polissacarídeos não amídicos ou não amiláceos - NSP (que tem como
principal enfoque a liberação de energia dos nutrientes). Essa divisão em dois
grandes grupos, apesar de utilizada comercialmente não tem um embasamento
técnico estritamente correto pois coloca no mesmo grupo de fitases enzimas com
origem, formas de atuação e efeitos de liberação de fósforo e liberação de
outros nutrientes distintos e no mesmo grupo de enzimas NSP enzimas e blends
enzimáticos que não necessariamente atuam sobre polissacarídeos não amiláceos
(como proteases, lípases e amilases por exemplo) e que são colocadas em um mesmo
grupo apenas por terem o principal efeito na maior liberação de energia dos
ingredientes presentes na ração.
Devido a esta grande extensão de conceitos e variáveis presentes nestes
dois grupos de enzimas, não seria possível abordar a todos em apenas uma
revisão. Preferiu-se, devido a isto, a abordagem nessa revisão dos efeitos da
utilização de fitases em rações de suínos, ficando a utilização de enzimas NSP
para uma segunda oportunidade.
O objetivo da presente revisão é de tentar descrever os efeitos da enzima
fitase em dietas para suínos, considerando as características do substrato onde
a mesma atua, o mecanismo de ação desta enzima, a ação e reflexo da mesma na
suinocultura.
1) Fitato
A substância na qual as enzimas fitases atuam são denominadas de três
formas distintas na literatura: Fitato, Ácido Fítico e Fitina. Fitato, o termo
utilizado com mais freqüência, refere-se ao sal misto de Ácido Fítico
(myo-inositol hexafosfato), fitina, por sua vez, refere-se especificamente ao
complexo de myo-inositol hexafosfato com potássio magnésio e cálcio, tal como
ocorre nas plantas, enquanto Ácido Fítico é a forma livre do anel de
myo-inositol hexafosfato (Selle e Ravindran, 2007).
De uma forma mais simples poderíamos dizer que a fitina presente nos
ingredientes vegetais presentes na composição das rações se solubilizam em pH
baixo (ácido) presente no início do trato gastro-intestinal dos suínos passando
a estar em sua forma livre, o ácido fítico. Á medida que o bolo alimentar
prossegue pelo trato gastro-intestinal e ocorre o aumento do pH (principalmente
a partir do duodeno onde ocorre a liberação do suco pancreático) o ácido fítico
então se complexa (quela ou liga-se) com minerais (cálcio principalmente),
proteínas (Selle et al, 2006) e enzimas específicas como amilase (Deshpande e
Cheryan, 1984), precipitando esse complexo para fora da solução aquosa do bolo
alimentar, formando o fitato (Figura 1). O efeito do fitato não está
relacionado apenas à redução da disponibilidade do fósforo presente na molécula
de myo-inositol hexafosfato, mas também na ligação desta molécula com outros
nutrientes e a precipitação deste complexo. Além da própria redução da
disponibilidade destes nutrientes que, a partir do momento que se ligam ao
fitato perdem atividade (enzimas) e/ou a capacidade de serem absorvidos, o
fitato tende também a aumentar a secreção de muco no intestino (Cowieson,
Acamovic e Bedford, 2004) atuando assim como um fator anti nutricional (Gráfico
1). A forma com que a precipitação de fitato age aumentando a secreção
intestinal ainda não está bem esclarecida, mas pode estar relacionada a ação
deste sal sobre a mucosa intestinal, sendo o aumento de secreção de muco uma
resposta à essa agressão.
Trabalhos demonstram ainda que a formação do fitato no trato intestinal
aumenta a produção de bicarbonato de sódio e sua excreção para o lúmen
intestinal (Cowieson et al, 2004) esse aumento na quantidade de sódio no lúmen
intestinal interfere por sua vez nos sistemas de transporte dependente de sódio
como a bomba de sódio e potássio e o transporte ativo de nutrientes para dentro
das células, interferindo, por exemplo na absorção de aminoácidos (Ravindran et
al., 2008).
Devido a esta ação anti-nutricional a variação na quantidade de fitato
presente na dieta pode interferir no desempenho zootécnico dos animais, no
padrão de resposta imune e na capacidade de absorção de ingredientes. Newkirk e
Classen (2001) observaram maior absorção de aminoácidos em frangos alimentados
com dietas a base de milho, soja e canola "definitizada" em
comparação à dieta padrão contendo canola sem passar por esse processo de
retirada da fitina, já Linneem et al. (2008) por sua vez, não observaram
diferença de desempenho zootécnico em suínos alimentados com milho naturalmente
com baixo teor de fitina em comparação com animais alimentados com um milho
padrão. É importante aqui salientar que o teor de fitina no milho é
naturalmente baixo, estando o teor de fitina da dieta mais ralacionado com o
teor do farelo de trigo e farelo de soja do que do milho, apesar da maior
participação desse ingrediente na ração. Liu et al. (2008) observaram variações
em padrões de resposta imune de frangos de corte alimentados com dietas
contendo baixa e alta concentração de fitato com distintas dosagens de fitase.
Em revisão de literatura, Selle et al. (2006) observaram que a resposta da
adição da digestibilidade de aminoácidos em frangos de corte pela adição de
fitase pode variar dependendo do tipo de marcador utilizado, sendo respostas
com utilização de óxido de titânio ou cinza insolúvel mais consistente do que
trabalhos com utilização de óxido crômico.
2) Fitases
Fitase é a classe enzimática que tem a utilização mais difundida na
nutrição de monogástricos, sendo comercializada a partir de 1991 (Selle, et
al., 2007), apesar do primeiro trabalho detectando a atividade desta enzima em
farelo de arroz datar de mais de 100 anos (Suzuki et al.: "Uber ein enzyme
"phytase" das anhydro-oxy-methylen-diphosphosaure spaltet"
College Agriculture Bulletin Tokyo Imperator University, 1907), este é um
mercado que movimenta mais de US$250 milhões/ano, com um crescimento de
Normalmente as fitases são classificadas em duas categorias, quanto a sua
origem (fúngica ou bacteriana) ou quanto ao local onde fazem a primeira
hidrólise na molécula de fitato, liberando o ortofosfato inorgânico (3-Fitase -
atuam inicialmente sobre o carbono 3 da molécula de fitato ou 6-Fitase - atuam
inicialmente sobre o carbono 6 da molécula de fitato).
Segundo Igsaban (2000) fitases bacterianas apresentam maior
estabilidade térmica (em especial fitases de Bacillus
sp) e maior estabilidade à ação proteolítica (em especial fitase de
E. coli) -
Gráfico 2, em
relação às fitases fúngicas essa maior
estabilidade à ação proteolítica pode
explicar os resultados encontrados por por Adeola et al. (2006) que
observaram
que fitases de E. coli
apresentam um maior valor de equivalência de Fósforo (isto
é, consegue liberar
maior quantidade de fósforo) em relação à
fitase fúngica, baseado na mineralização
do terceiro osso de metacarpo de suínos em crescimento.
Já segundo McGinnis (2007), uma fitase bacteriana comercial teve maior
capacidade de quebrar o fitato no duodeno de suínos em crescimento que um
produto de origem fúngica.
A característica do fitato formar quelatos e cristalizar em pH básico é
extremamente importante para a eficiência in
vivo das fitases. Isso ocorre pois devido a esta característica é
necessário que a fitase esteja ativa em pH baixo (estômago), quando o ácido
fítico está solúvel e pode ser quebrado, a partir do momento em que o bolo
alimentar chega ao intestino e as secreções pancreáticas aumentam o pH, ocorre
a formação destes cristais e por mais que a fitase esteja ativa, o substrato
(fitato) não estará mais disponível, fazendo com que a hidrólise do
fitato ocorra principalmente no estômago (Selle, 2007).
3) Utilização de enzimas fitase em ração para
suínos
A
utilização de fitase em rações de
suínos aumenta a liberação do fósforo
presente no ácido fítico e redução da
ação antinutricional do fitato,
possibilitando assim reduzir o uso de fontes inorgânicas de
fósforo ou
ainda de produtos de origem animal (como farinha de carne e
ossos) para
se alcançar o nível exigido por cada fase de
produção. Essa utilização
apresenta dois objetivos principais, a questão econômica
(somando-se à
liberação de fósforo o aumento da digestibilidade
de aminoácidos e a
metabolizabilidade da energia) que propicia a produção de
uma ração com um
custo inferior à ração sem adição de
fitase mas mantendo o mesmo desempenho
zootécnico, e a questão ambiental pois o aumento da
disponibilidade de fósforo,
traz uma redução na excreção deste elemento
para o meio ambinente.
Como
dito, a adição de fitase em ração de
suínos possibilita reduzir a
adição de fontes de fósforo na
ração, uma vez que libera o fósforo ligado
à
molécula de fitato (Cromwell, 1991), tornando-a
disponível para ser utilizada
pelo animal (Cromwell, 1993; Cromwell et al., 1995; Lei et al., 1993;
Jendza et
al., 2004). Além de disponibilizar fósforo, a
adição de fitase em ração de
suínos interfere no fluxo biológico deste ingrediente do
trato
gastro-intestinal para os ossos e dos ossos e tecidos moles para o
trato
intestinal de suínos (Moreira et al., 2004) e pode interferir na
absorção de
outros minerais como o zinco (Ao et al., 2007). A intensidade de
ação desta
enzima, entretanto, depende também de outros fatores, dentre os
quais a relação
entre cálcio e fósforo da ração, quanto
maior a relação (maior a quantidade de
fósforo), menor a quantidade de fósforo liberada
(Beaulieu, 2005; Adeola,
2006). A combinação de adição de fitase e
redução de cálcio e fósforo aumenta a
digestibilidade ileal aparente de aminoácidos, nitrogênio,
amido, matéria seca,
cálcio, fósforo e energia bruta, sendo estas respostas
sustentadas pelo aumento
da glicemia e insulina plasmática após o consumo da
ração em relação a animais
consumindo ração sem adição de fitase. Com
a maior disponibilidade de cálcio e
fósforo para a absorção pelo animal, a quantidade
destes nutrientes é reduzida
no trato intestinal, o que pode ainda modular o crescimento
bacteriano,
Metzeler et al. (2008) observaram que a adição de fitase
em dietas de baixo
fósforo reduz a incorporação de fósforo
pelas bactérias e parece reduzir a
atividade das mesmas no trato intestinal.
Outra
questão importante quando da utilização de fitase
em ração para
suínos é a redução da
excreção de fósforo para o meio ambiente
através das
fezes e o impacto ambiental que esse mineral pode causar. As fezes dos
animais,
se não corretamente tratadas seguem para os cursos d'água
onde a poluição por
fósforo é um perigo para a qualidade da água
(Selle, 2007). Concentrações altas
de fósforo são causas comuns de
eutrofização de rios, lagos e reservas
(Correll, 1999), A lixiviação de solos com alta
concentração de fósforo acelera
a eutrofização, podendo causar crescimento de algas
tóxicas e mortalidade de
peixes (Sharpley, 1999). Lora et al. (2007) citaram que a
redução do teor de
fósforo da dieta e a adição de fitase possibilitou
a manutenção do resultado
zootécnico dos animais, com redução da
excreção de fósforo nas fezes,
entretanto, segundo Selle (2007) a preocupação não
deveria ser apenas o fósforo
nas excretas mas sim a quantidade de fósforo solúvel
presente, por ser este o
principal causador da eutrofização. Segundo Miles et al.
(2003), um aumento na
quantidade de fósforo solúvel na excreta de frangos
alimentados com fitase em
relação às aves controle, já Applegate et
al. (2003) observaram a redução deste
teor. A principal diferença entre ambos experimentos é
que no experimento de
Applegate a concentração de fósforo era mais
baixa, o que pode ter influenciado
no resultado final. Já segundo Beaulieu (2005), em suínos
em fase inicial, a
excreção de fósforo solúvel depende
não apenas do teor de fósforo mas da
relação cálcio-fósforo da dieta, sendo que
a adição de fitase reduz a excreção
de fósforo total e solúvel em rações
iniciais a base de milho e soja, mas esse
efeito se reduz quando a relação entre cálcio e
fósforo é superior a 1,7.
Conclusões
A utilização de enzimas, e mais especificamente fitases em rações não é
somente uma forte tendência, mas uma realidade na suinocultura nacional e
mundial, devido não somente aos benefícios econômicos (redução de custo de
produção), mas também aos benefícios ambientais (redução de
excreção de nutrientes) e outros (modulação bacteriana, redução de ação
antinutricional, etc).
Isso não significa, entretanto que este seja um tema totalmente
esclarecido na nutrição de suínos, a diferença de ação entre enzimas de origem
distintas e até mesmo a diferença entre produtos de mesma origem, o
desenvolvimento de variáveis de cereais e vegetais com menor teor de fitato e o
desenvolvimento de novas fitases vêm ocorrendo e deverão continuar evoluindo no
decorrer dos próximos anos.
Manter
em mente que as fitases apresentam características distintas e
buscar um produto que tenha estabilidade em pH, resistência ao
processo de
produção de ração, resistência
à ação proteolítica, estabilidade no trato
digestivo do animal como o descrito por Igsaban como a fitase ideal e o
melhor
custo benefício é importante para tentar definir o melhor
produto para a
realidade da empresa onde o mesmo será empregado, obtendo assim
o máximo desta
tecnologia, expresso de forma prática em maior desempenho
animal, menor custo
de produção e maior ganho econômico para a empresa.
Bibliografia
- Adeola, O.; Olukosi,
O.A.; Jendza, J.A.; Dilger,
R.N. e Bedford, M.R. Response of growing pigs to Peniphora lycii e Escherichia coli derived phytase or varying ratios of calcium to total phosphorus. Journal
of Animal Science, 82: 637-644;
- Ao, T et al., effects of organic zinc and phytase supplementation in a maize-soybean meal diet on the
performance and tissue zinc content of broiler chicks. British poultry Science,
48:690-695, 2007;
- Applegate, T.J. et al. Water-soluble phosphorus in fresh broiler
litter is dependent upon phosphorus concentration fed but not on fungal phytase supplementation. Poultry Science, 82: 1024-1029,
2003;
- Beaulieu, A.D.;
- Correll, D.L. Phosphorus: a rate limiting
nutrient in surface waters. Poultry Science, 78: 674-682, 1999;
- Cowieson, A.J.; Acamovic,
T. e
- Cowieson, A.J.; Selle, P.H. e Ravindran, V. Uso de Fitase e suas
implicações na digestão e absorção de nutrientes. Anais da Conferência APINCO 2008, 2008;
- Cromwell, G.L. Phytase appers
to reduce phosphorus in feed manure. Feedstuffs, 63:41, 1991;
- Cromwell, G.L. et al. Efficacy of phytase in
improving the bioavailability of phosphorus in soybean meal and corn-soybean
meal diets for pigs. Journal of Animal Science, 71: 1831-1840, 1993;
- Cromwell, G.L. et al. Efficacy of low-activity microbial phytase in improving the bioavailability of phosphorus in
corn-soybean meal diets for pigs. Journal of Animal Science, 73: 449-456, 1995;
- Deshpande, S.S e Cheryan,
M. Effects of phytic acid, divalent cátions, and their interaction on α-amilase activity. Journal of food science, 49: 516-524;
- Igbasan, F.A.; Manner, K.; Miksch, G.; Borriss, R.; Farouk,
A. Simon, O. Comparative studies on the in vitro properties of phytases from various microbial origins. Arch Tierernahr, 53:353-373;
- Jendza, J.A.; Dilger,
R.N.; Bedford, M.R.; Adeola, O. Response of pigs to
dietary phytase and calcium-to-phosphorus ratio. Journal
of Animal Science 83: Suppl.1,175, 2004;
- Lei, X.G. et al. Supplementing corn-soybean
diets with microbial phytase linearly improves phytase phosphorus utilization by weanling pigs. Journal of
Animal Science, 71: 3359-3367, 1993
- Linneen, S.K.; DeRouchey,
J.M.; Goodband, R.D.; Tokach,
M.D.; Dritz, S.S.; Nelssen,
J.L. e Snow, J.L. Evaluation of NutriDense low-phytate corn and added fat in growing and finishing swine
diets. Journal of Animal Science, 86:1556-1561, 2008;
- Liu, N; Ru, Y.J.; Cowieson,
A.J.; Li, F.D. e Cheng, X.C.H. Effects of phytate and
phytase on the performance and immune function of
broilers fed nutritionally marginal diets. Poultry
Science, 87: 1105-1111, 2008;
- Lora, A.G. et al. Redução da excreção de nutrientes pelo uso de
diferentes estratégias nutricionais em aves e suínos. Anais do Congresso
Internacional sobre Nutrição Animal e Alimentos Seguros.
- McGinnis, L.M. et al. Site of activity within the digestive tract of
growing pigs of an evolved E. coli
derived and a fingal derived commercial phytase. Journal of Animal Science, 85, Suppl
2: 46, 2007
- Meng, X; B.A. Slominski;
C.M. Nyachoti; L.D. Campbell e W. Guenter.
Degradation off cell wall polisaccharides
by combination of carbohydrase enzymes and their
effect on nutrient utilization and broiler chicken performance. Poultry
Science, 84: 37-47, 2005;
- Metzler, B.U.; Mosenthin, R.; Baumgärtel, T.; Rodehutscord, M. The effect of dietary phosphorus and calcium level, phytase supplementation, and ileal
infusion of pectin on the chemical composition and carbohydrase
activity of fecal bacteria and the level of microbial metabolites in the
gastrointestinal tract of pigs. Journal of Animal Science, 86:
1544-1555, 2008;
- Miles, R.D. et al. Total and water-soluble phosphorus in broiler
litter over three flocks with alum litter treatment and dietary inclusion of
high available phosphorus corn and phytase
supplementation. Poultry Science, 82, 1544-1549, 2003;
- Moreira, J.A.; Vitti, D.M.S.S.; Lopes, J.B.; Neto, M.A.T. Fluxo biológico
do fósforo no metabolismo de suínos alimentados com dietas contendo fitase. Revista Brasileira de Zootecnia, 33:
2066-2075, 2004;
- Newkirk, R.W. e Classen
H. L. The non-mineral nutritional impact of phytate
in canola meal fed to broilers chicks. Animal Feed Science Technology, 91:
115-128, 2001;
- Ravindran, V.; Cowieson,
A.J.; Selle, P.H. Influence of dietary electrolyte
balance and microbial phytase on growth performance
and nutrient utilization, and excreta quality of broiler chickens. Poultry
Science, 87:677-688, 2008;
- Selle, P.H.; Ravindran,
V.; Bryden, W.L.; Scott, T¨. Influence of dietary phytate and exogenous phytase on
amino acid digestibility in poultry: a review. The Journal of Poultry Science,
43: 89-103, 2006a;
- Selle, P.H; Ravindran,
V. Microbial phytase in poultry nutrition. Animal
Feed Science and Technology, 135: 1-41, 2007;
- Sharpley, A. Agricultural phosphorus, water
quality and poultry production, are they compatible? Poultry Science
78:660-673, 1999;
Figura 1: Diferentes solubilizações do fitato dependendo da porção do trato
intestinal que se encontra. A) Porção inicial/ração (pH
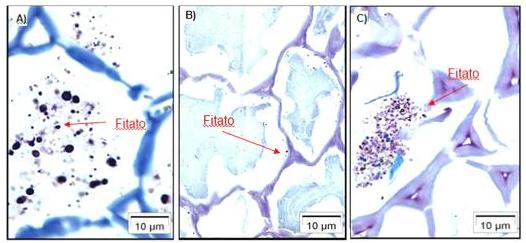
Gráfico 1: Estimativa de produção de muco a partir da excreção de Ácido
Siálico em aves consumindo glucose, fitato, fitase e fitato+glucose
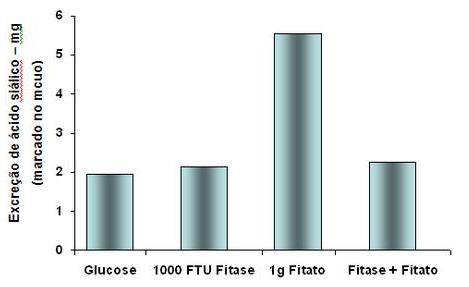
Fonte: Adaptado de Cowieson, Acamovic e
Bedford, 2004
Gráfico 2: Atividade residual de diversas fontes de fitase após desafio
gástrico (pH
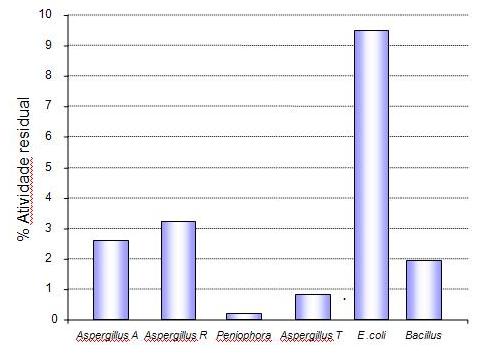
Fonte: Adaptado de Igbasan et al. (2000)